3. TEPELNÁ
KAPACITA - TEPLO A
ODLIŠNÉ LÁTKY
Fyzikálny princíp:
Tepelná kapacita jednotky hmotnosti rozličných látok je rôzna, preto je
hmotnostná tepelná kapacita jednou z materiálových konštánt. Ak (1-1)
dosadíme do (1-3), dostaneme vzťah
c=Q/(m.DT),
resp. c=Q/(m.Dt)
(1). Jednotkou hmotnostnej tepelnej kapacity je joule na kilogram a
kelvin (J.kg-1. K-1). Tepelná kapacita a teda aj
hmotnostná tepelná kapacita závisí od podmienok, pri ktorých k ohrievaniu,
alebo ochladzovaniu telesa dochádza. Preto rozlišujeme hmotnostnú tepelnú
kapacitu pri stálom tlaku cp a hmotnostnú tepelnú kapacitu pri stálom
objeme cv. U kvapalín a tuhých látok sú v bežných (nie
extrémnych) prípadoch hmotnostné tepelné kapacity cp a cv
takmer rovnaké, zatiaľ čo u plynov je vždy cp > cv.
Hmotnostná tepelná kapacita látky závisí aj od teploty.
Hmotnostné
tepelné kapacity sa bežne určujú pomocou kalorimetrov. Kalorimeter je
tepelne izolovaná nádoba, v ktorej skúmanej látke dodávame známe množstvo
tepla Q. Ak nedochádza pri dodávaní tepla v kalorimetri k inému
deju (napr. k chemickým reakciám, skupenským premenám) ako k zohrievaniu
skúmanej látky, môžeme pre jej hmotnostnú tepelnú kapacitu na základe
rovnice (1) písať vzťah
c=Q/(m.(t-t1))
(2), v ktorom m znamená hmotnosť vyšetrovanej látky, t1 jej teplotu pred dodávaním tepla a t teplotu
po dodaní tepla. Takto definovaná hmotnostná tepelná kapacita c
je strednou hodnotou hmotnostnej tepelnej kapacity z intervalu teplôt (t1
, t).
Cieľ:
1.
Ukázať, že zmena teploty dvoch rôznych látok rovnakej hmotnosti, ktoré za
určitý čas príjmu, alebo odovzdajú rovnaké množstvo tepla, nie je rovnaká.
2. Ukázať, že dvom odlišným látkam rovnakej hmotnosti je potrebné dodať
alebo odobrať rôzne množstvá tepla na dosiahnutie rovnakej teplotnej zmeny.
3. Určiť hmotnostnú tepelnú kapacitu vody a etylénglykolu.
Pomôcky:
izolovaná nádoba (250ml), ponorná špirála konštantného výkonu, odmerný
valec, voda, etylénglykol (fridex), tyčinka na miešanie, stojan s držiakom,
váhy, teplotná sonda, mikropočítač s prevodníkom a meracím panelom.
Príprava:
Nalejeme 200g vody resp. etylénglykolu do izolovanej nádoby a ďalej
postupujeme rovnako ako v príprave experimentu 1.
Realizácia:
Meranie realizujeme s 200g vody, resp. 200g etylénglykolu rovnakým spôsobom
ako v experimente 1.
Spracovanie: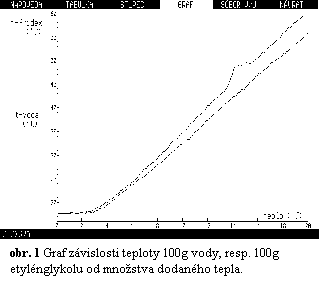
V programe
Tabuľkový kalkulátor vložíme do
stĺpca s3 hodnoty teploty pre 200g vody a označíme ho vypísaním jeho hlavičky.
V stĺpci s2 sú teploty zaznamenané pri zohrievaní 200g etylénglykolu,
ktoré sa preniesli spolu so stĺpcom s1, v ktorom sú vpísané časy
merania teploty, z Multiskopu.
Aby sme mohli graficky znázorniť vzťah dodanej tepelnej energie a teploty,
vložíme do stĺpca s4 hodnoty tepelnej energie dodanej vode za jednotlivé
časové úseky (STĹPEC/VZOREC/s4:
220*220/R*s1) a označíme ho vypísaním jeho hlavičky. Súradnicovým osiam
grafov A, B, C, D priradíme jednotlivé veličiny tak, aby grafy A, B
vyjadrovali závislosť teploty vody, resp. etylénglykolu na čase a grafy C, D
závislosť teploty vody, resp. etylénglykolu od množstva dodaného tepla. Z grafov
A, B určíme v programe Spracovanie
rozdiel medzi teplotou vody a etylénglykolu po 10s, 20s, ... ,50s od začiatku
zohrievania. Hmotnostnú tepelnú kapacitu vody a etylénglykolu môžeme
určiť tak, že získame v programe Spracovanie
smernice grafov, ktorých osi okalibrujeme opačne ako osi grafov C, D a predelíme
ich príslušnými hmotnosťami. Namerané hodnoty hmotnostnej tepelnej kapacity
porovnáme s tabuľkovými hodnotami a zistíme relatívnu chybu
merania. Príklad grafu, ktorý vyjadruje vzťah medzi dodaným teplom 100g
vody, resp. 100g etylénglykolu a teplotou je na obr. 1.
Otázky:
Ktorej
látke potrebujeme dodať väčšie množstvo tepla nato, aby sa ohriala napr. o
40˚C?
Ktorá
látka absorbuje viac tepla pri zohriatí o 1˚C?