2. TEPELNÁ
KAPACITA - TEPLO A
HMOTNOSŤ
Fyzikálny
princíp:
K tomu,
aby sa chemicky rovnorodé telesá rovnakej počiatočnej teploty, ale rôznych
hmotností, ohriali na rovnakú teplotu potrebujú, aby im bolo dodané rôzne
množstvo tepla, a to tým väčšie, čím väčšia je hmotnosť telesa.
Možno preto písať C = c.m (1),
kde c je konštanta úmernosti,
nazývaná hmotnostná tepelná
kapacita (v nedávnej minulosti nazývaná merná tepelná kapacita).
Cieľ:
Ukázať
vzájomný vzťah medzi teplom, ktoré treba dodať vode na určitú
teplotnú
zmenu a hmotnosťou vody.
Pomôcky:
izolované
nádoby (150 ml, 250 ml, 350 ml), ponorná špirála konštantného výkonu,
odmerný valec, tyčinka na miešanie, stojan s držiakom, teplotná
sonda, mikropočítač s prevodníkom a meracím panelom, program IP-COACH
Príprava:
Postupujeme rovnako ako v príprave experimentu 1. Meranie začneme
s 300g vody.
Realizácia:
Po
spustení merania zapneme špirálu a začneme miešačkou premiešavať
vodu. Súčasne sledujeme na obrazovke monitora zmeny teploty, ktoré
zaznamenáva počítač. Keď dosiahne teplota vody 80˚C, vypneme špirálu
a ukončíme meranie. Po uložení výsledkov na disk zopakujeme postup
najprv pre 200g studenej vody a nakoniec pre 100g. Pred opätovným
spustením merania nemeníme nastavenie, aby sme mohli na monitore porovnávať
zmeny teploty pre rôzne hmotnosti. Meranie pre 300g môžeme vynechať,
ak využijeme výsledky z predchádzajúceho experimentu, ktoré si pred meraním
pre 200g vody vložíme spolu s nastavením do pamäte počítača.
Merania pre 100g, 200g aj 300g by mali byť ukončené po uplynutí
rovnakej doby od spustenia merania, aby sme nemali problémy pri spracovaní
výsledkov v programoch Tabuľkový
kalkulátor a Spracovanie.
Pri meraní použijeme tri rôzne izolované nádoby, aby špirála bola
úplne ponorená do vody.
Spracovanie: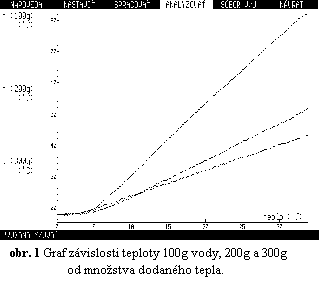
Vytvoríme grafy, ktoré budú vyjadrovať vzťah dodaného
tepla a teploty, pre jednotlivé hmotnosti vody. V programe Tabuľkový kalkulátor vložíme do stĺpca s3 hodnoty teploty
pre 200g vody (SÚBOR/Výsledky/Vložiť/...).
V stĺpci s2 máme zobrazené hodnoty teploty pre 100g vody, v stĺpci
s1 doby merania teploty, ktoré zostali v pamäti pri prepnutí z Multiskopu.
Do stĺpca s4 vložíme hodnoty teploty pre 300g vody podobne ako sme vložili
pre 200g. Hodnoty tepelnej energie dodanej vode za jednotlivé časové úseky
vpíšeme do stĺpca s5 (STĹPEC
/VZOREC/s5: 220*220/R*s1) a označíme jednotlivé stĺpce vypísaním
hlavičky. Grafy A, B, C okalibrujeme tak, že y-ovej osi priradíme
teplotu pre jednotlivé hmotnosti a x-ovej osi priradíme vo všetkých prípadoch
energiu (s5). Zobrazíme grafy závislosti teploty od množstva dodaného
tepla pre 100g, 200g a 300g vody, porovnáme ich a pomocou programu Spracovanie
určíme teplá Q1, Q2, Q3 , ktoré sa
spotrebovali na zmenu teploty 100g vody napr. o 40˚C, 200g o
40˚C a 300g o 40˚C tak, že odčítame veľkosť dodaného
tepla pri teplote 65˚C a 25˚C pre všetky hmotnosti. Porovnáme
teplo Q1 s teplom Q2 a teplom Q3 .
Určíme vzájomný vzťah medzi dodaným teplom a hmotnosťou pre
rovnakú teplotnú zmenu tej istej látky. Uvážime zdroje tepelných strát
v experimente. Príklad grafu, ktorý vyjadruje vzťah medzi dodaným
teplom vode hmotnosti 100g, 200g, 300g a teplotou vody je na obr. 1.
Poznámka:
Ak sme merania neukončili po rovnakom čase, vzniknú v stĺpcoch,
do ktorých vkladáme výsledky, prázdne bunky. Pri prechode z programu
Tabuľkový kalkulátor do
programu Spracovanie sa neprenesú
riadky, v ktorých sú prázdne bunky a grafy sa nezobrazia celé. Keď
nebudeme môcť odčítať hodnoty tepla pri teplote 65˚C, zmeníme
teplotný interval, pomocou ktorého budeme určovať Q1, Q2 a
Q3, alebo spracovanie urobíme pre jednotlivé merania osobitne
tak, že vložíme do Tabuľkového
kalkulátora nastavenia a výsledky len z jedného merania, doplníme
stĺpec dodanej energie a určíme Q1, vložíme ďalšie výsledky
a zistíme Q2, resp. Q3.