Sulfán
1.
Príprava sulfánu
Princíp práce
Sulfán
H2S pripravíme reakciou kyseliny chlorovodíkovej
so sulfidom železnatým: FeS + HCl ®
FeCl2 + H2S
Sulfidové ióny S2- reagujú ako silná
Bronstedtova zásada – sú akceptormi H+. V prvom
stupni vzniká hydrogensulfid HS- a v druhom
stupni vzniká sulfán H2S.
Pomôcky
a chemikálie
 jednoduchý
vyvíjač plynu, adsorpčná
trubička, sulfid železnatý
FeS, kyselina chlorovodíková HCl (koncentrovaná) jednoduchý
vyvíjač plynu, adsorpčná
trubička, sulfid železnatý
FeS, kyselina chlorovodíková HCl (koncentrovaná)
Postup
práce
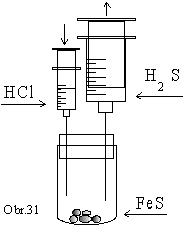
Do
skúmavky jednoduchého vyvíjača plynu dáme kúsky sulfidu
železnatého. K sulfidu železnatému v skúmavke
pomaly prikvapkávame z 5 cm3 injekčnej striekačky
koncentrovanú kyselinu chlorovodíkovu. 50 cm3 injekčná
striekačka sa napĺňa vznikajúcim sulfánom (obr.31).
Naplnenú injekčnú striekačku nahradíme adsorpčnou rúrkou
s aktívnym uhlím, ktorá adsorbuje unikajúci plyn.
Poznámky
Sulfid
železnatý FeS použitý na prípravu sulfánu nesmie byť príliš
hrubozrný.
Bezpečnosť
Sulfán
je extrémne jedovatý (porovnateľne s kyanovodíkom HCN)
- vdychovaný i v nepatrných množstvách spôsobuje
bolesti hlavy, závraty a nevoľnosť, vo väčšej koncentrácii
aj smrť. Nebezpečenstvo spočíva predovšetkým v tom,
že sulfán vo väčšej koncentrácii silne poškodzuje čuchový
nerv a jeho nebezpečné koncentrácie už potom nevnímame.
Zneškodnenie
splodín
·
Nadbytočný sulfán vedieme do
hydroxidu sodného NaOH. Rovnako, pomocou druhej injekčnej
ihly, zabezpečíme hydroxidom sodným aj adsorpčnú rúrku
na vyvíjači plynu.
·
Vzniknuté rozpustné sulfidy
odplavíme väčším množstvom vody do výlevky.
2.
Vlastnosti sulfánu
Sulfán
je bezfarebný, veľmi jedovatý, odporne zapáchajúci (ako
skazené vajcia) plyn. Je ťažší ako vzduch, horľavý,
dobre rozpustný vo vode. Vodný roztok sulfánu je slabo kyslý.
Sulfán reaguje s niektorými kovmi za vzniku sulfidov, s oxidom
siričitým za
vzniku elementárnej síry.
a)
rozpustnosť
sulfánu
vo vode
Princíp
práce
Sulfán
je dobre rozpustný vo vode. Pri laboratórnej teplote sa v jednom
objeme vody rozpustí dva a pol objemu sulfánu. Vzniká veľmi
slabá kyselina sulfánová (sulfánová voda):
H2S ®
H+
+ HS-
HS- ®
H+ +
S2-
Pomôcky
a chemikálie
50
cm3 injekčná striekačka naplnená sulfánom H2S,
skúmavka, acidobázický indikátor (metyloranž)
Postup
práce
Z injekčnej
striekačky vytlačíme cez injekčnú ihlu do skúmavky
naplnenej vodou pripravený sulfán. K roztoku sulfánu
pridáme niekoľko kvapiek metyloranže.
Pozorovanie
Roztok
zčervenie, čo dokazuje vznik kyseliny.
b)
horľavosť
sulfánu
Princíp
práce
Sulfán
na vzduchu horí modrastým plameňom. Produktmi horenia sú
oxid siričitý a voda:
2 H2S + 3 O2
®
2 SO2 +
2 H2O
Pomôcky
a chemikálie
50
cm3 injekčná striekačka naplnená sulfánom H2S,
injekčná ihla, skúmavka, zapaľovač, indikátorový
papierik
Postup
práce
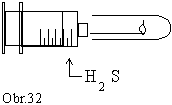 Na
50 cm3 injekčnú striekačku naplnenú sulfánom
nasadíme novú injekčnú ihlu. Sulfán rovnomerne vytláčame
zo striekačky a pri hrote ihly ho zapálime zapaľovačom.
Plameň horiaceho sulfánu vložíme do suchej, vodorovne držanej,
skúmavky (obr.32). Vznikajúci oxid siričitý zachytávame v skúmavke
dovtedy, kým plameň
nezhasne. K plynu v skúmavke potom pridáme trochu
vody a obsah skúmavky premiešame. Na
50 cm3 injekčnú striekačku naplnenú sulfánom
nasadíme novú injekčnú ihlu. Sulfán rovnomerne vytláčame
zo striekačky a pri hrote ihly ho zapálime zapaľovačom.
Plameň horiaceho sulfánu vložíme do suchej, vodorovne držanej,
skúmavky (obr.32). Vznikajúci oxid siričitý zachytávame v skúmavke
dovtedy, kým plameň
nezhasne. K plynu v skúmavke potom pridáme trochu
vody a obsah skúmavky premiešame.
Pozorovanie
Prítomnosť
vody dokazuje orosenie suchých chladných stien skúmavky.
Vznik oxidu siričitého zistíme už čuchom. Jeho zmiešaním
s vodou vznikne kyselina siričitá, ktorú dokážeme
indikátorovým papierikom alebo
iným acidobázickým indikátorom.
c)
výbušnosť
zmesi sulfánu a kyslíka
Princíp
práce
Zmes
sulfánu a kyslíka po zapálení zhorí explozívnym vyšľahnutím
plameňa. Produktmi horenia sú oxid siričitý a voda:
2 H2S + 3 O2 ®
2 SO2 +
2 H2O
Pomôcky
a chemikálie
skúmavka
s gumovou zátkou, sklenená vaňa, kahan, 50 cm3 injekčná
striekačka naplnená sulfánom H2S, 50 cm3 injekčná
striekačka naplnená kyslíkom O2
Postup
práce
Skúmavku
naplníme vodou, uzavrieme palcom a vložíme hore dnom do
sklenenej vane. Skúmavku pod vodou naplníme minimálne od
dvoch pätín maximálne do dvoch tretín objemu pripraveným
sulfánom. Zvyšok objemu doplníme pripraveným kyslíkom. Skúmavku
pod vodou uzavrieme gumenou zátkou. Po vybratí z vody
celú skúmavku, okrem ústia,
obalíme utierkou. Skúmavku otvoríme a priblížime
jej ústie k plameňu kahana.
Pozorovanie
Po
priblížení ústia skúmavky k plameňu kahana dôjde k menšiemu
výbuchu, ktorý často plameň uhasí. Zároveň zacítime štipľavý
zápach oxidu siričitého.
d)
reakcia
sulfánu s oxidom siričitým
Princíp
práce
Reakciu
sulfánu s oxidom
siričitým vyjadruje chemická rovnica:
2 H2S + SO2
®
2 H2O + 3 S
Pomôcky
a chemikálie
jednoduchý
vyvíjač plynu na prípravu oxidu siričitého, adsorpčná
trubička, 50 cm3 injekčná striekačka naplnená
40 cm3 sulfánu H2S, siričitan sodný,
kyselina chlorovodíková HCl alebo kyselina sírová H2SO4
(w=10 %),
Postup
práce
K
40 cm3 sulfánu
v injekčnej striekačke pridáme 20 cm3 oxidu
siričitého, ktorý si pripravíme pomocou príslušného
jednoduchého vyvíjača plynu.
Pozorovanie
Na
stenách 50 cm3
injekčnej striekačky sa okamžite zráža žltá síra.
e)
reakcia
sulfánu s kovmi
Princíp
práce
Ak
do roztoku niektorých kovov zavádzame plynný sulfán, vylúčia
sa zrazeniny kovových sulfidov. Takto môžeme napríklad
pripraviť sulfid meďnatý, sulfid olovnatý, sulfid
strieborný (všetky tri zlúčeniny sú čierne tuhé látky).
CuSO4 + H2S
®
CuS + H2SO4
Pomôcky
a chemikálie
50
cm3 injekčná striekačka naplnená sulfánom H2S,
skúmavka, roztok síranu meďnatého CuSO4
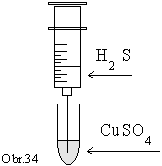 Postup
práce Postup
práce
Pripravený
sulfán vytláčame z injekčnej striekačky cez ihlu do
roztoku síranu meďnatého v skúmavke. Ihlu pri zavádzaní
sulfánu ponoríme čo najhlbšie do roztoku (obr.34).
Pozorovanie
Pozorujeme
vznik čiernej zrazeniny sulfidu meďnatého.
f)
reakcia
sulfánu s chlórom
Princíp
práce
Sulfán
má silné redukčné účinky. Pri reakcii s halogénmi vzniká
príslušný halogenid a vylučuje sa elementárna síra:
H2S + Cl2
®
2 HCl + S
Reakcie prebiehajú vo vodných roztokoch (jedna z reagujúcich
látok musí byť rozpustená vo vode) a používajú sa na prípravu
čistej kyseliny bromovodíkovej a kyseliny jodovodíkovej.
Pomôcky
a chemikálie
skúmavka,
indikátorový papierik, sulfánová voda, 50 cm3 injekčná
striekačka naplnená plynným chlórom Cl2
Postup
práce
Do
skúmavky so sulfánovou vodou vytlačíme z 50 cm3 injekčnej
striekačky pripravený plynný chlór.
Pozorovanie
Pôsobením
chlóru sa sulfánová voda zakalí. Vylučuje sa biely zákal
síry. Roztok má v dôsledku vzniku kyseliny chlorovodíkovej
slabo kyslú reakciu, ktorú dokážeme použitím indikátorového
papierika.
g)
poznámky
k pokusom
ad
a) rozpustnosť sulfánu vo vode
·
Ak sulfánovú vodu uschováme v dobre
uzavretej hnedej fľaši, môžeme ju použiť ešte za 2-3 týždne.
ad
c) výbušnosť zmesi sulfánu a kyslíka
·
Zmes
kyslíka so sulfánom je veľmi výbušná.
·
Pokus možno urobiť aj so
zmesou vzduchu so sulfánom. Reakcia nie je taká prudká,
zmes plynov reaguje so slabším zvukovým efektom.
ad
e) reakcia sulfánu s kovmi
·
Môžeme použiť aj roztoky solí
iných kovov.
ad
f) reakcia sulfánu s chlórom
·
Reakciu chlóru so sulfánom môžeme
uskutočniť aj v plynnom skupenstve. Zmiešame obidva
plyny v skúmavke, uzatvoríme a pretrepeme. Pozorujeme
vznik bieleho dymu (zmes chlorovodíka a síry).
·
Podobne reaguje so sulfánom aj
bróm. Do brómovej vody zavedieme pripravený plynný sulfán,
ktorý spôsobí postupné odfarbenie brómovej vody a vylučovanie
síry (biely zákal).
|