Amoniak
1. Príprava amoniaku
Princíp práce
Hydroxid
sodný NaOH a amoniak NH3 tvoria zásadité vodné
roztoky. Použitím tuhého granulovaného hydroxidu sodného
NaOH môžeme z roztokov amoniaku NH4OH
znovu získavať plynný amoniak NH3. OH-
ióny v roztoku spôsobujú posun rovnováhy v smere:
NH4+ + OH-
®
NH3 + H2O
Pomôcky a chemikálie
jednoduchý
vyvíjač plynu, hydroxid sodný NaOH (granulovaný),
koncentrovaný roztok amoniaku NH4OH (w=25%)
 Postup
práce Postup
práce
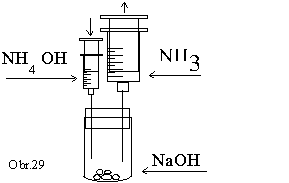
Skúmavku
jednoduchého vyvíjača plynu naplníme asi 5 granulami
hydroxidu sodného. K hydroxidu sodnému po kvapkách
pridávame koncentrovaný roztok hydroxidu amónneho z 5 cm3
injekčnej striekačky. Veľmi rýchlo vzniká plynný
amoniak, ktorý zachytávame
v 50 cm3 injekčnej striekačke (obr.29).
Zneškodnenie
splodín
·
Nespotrebovaný roztok amoniaku
vrátime do zásobnej fľaše.
·
Roztok hydroxidu v skúmavke
zriedime vodou a vylejeme do výlevky.
2.
Vlastnosti amoniaku
Amoniak
je bezfarebný plyn štipľavého zápachu, ľahší ako
vzduch, dobre rozpustný vo vode. Je to slabá zásada, s kyselinami
tvorí príslušné soli.
a)
dôkaz
amoniaku
Princíp
práce
Amoniak
je slabá zásada. Jeho zásadité vlastnosti dokážeme použitím
vhodného acidobázického indikátora.
Pomôcky
a chemikálie
skúmavka,
filtračný papier, 50 cm3 injekčná striekačka
naplnená plynným amoniakom, kyselina
chlorovodíková HCl (koncentrovaná), roztok fenolftaleínu
Postup práce
Pripravený
amoniak vytláčame z 50 cm3 injekčnej striekačky
·
do skúmavky s koncentrovanou
kyselinou chlorovodíkovou
·
do skúmavky naplnenej vodným
roztokom fenolftaleínu
·
na filtračný papier, ktorý
sme predtým popísali roztokom
fenolftaleínu.
Pozorovanie
·
Amoniak reaguje s kyselinou
chlorovodíkovou za vzniku chloridu amónneho (salmiaku):
NH3 + HCl
®
NH4Cl
·
V zásaditom prostredí
dochádza k sfarbeniu roztoku fenolftaleínu.
·
Roztokom fenolftaleínu popísané
časti filtračného papiera sa sfarbia na fialovo. Farebná
zmena indikátora poukazuje na prítomnosť OH- iónov
v roztoku:
NH3 + H2O
®
NH4+ + OH-
Ide o rovnovážnu reakciu. Ak filtračným papierom zamávame,
odstránime z neho ľahko prchavý amoniak a rovnováha
reakcie sa posunie na stranu reaktantov. Nastane úbytok OH-
iónov čo sa prejaví odfarbením indikátora.
b)
rozpustnosť
amoniaku vo vode (amoniaková fontána)
Princíp
práce
Amoniak
je veľmi dobre rozpustný vo vode. Jeho rozpustením vo vode
vzniká zásaditý vodný roztok amoniaku.
Pomôcky
a chemikálie
jednoduchý
vyvíjač plynu, gumená hadička, skúmavka, 50 cm3
injekčná striekačka s ihlou, hydroxid sodný NaOH
(granulovaný), koncentrovaný roztok hydroxidu amónneho NH4OH
(w=25%), fenolftaleín, indikátorový papierik
Postup
práce
 Skúmavku
jednoduchého vyvíjača plynu naplníme asi 5 granulami
hydroxidu sodného. Na jednu
injekčnú ihlu nasadíme 5 cm3 injekčnú striekačku,
na druhú nasadíme gumenú hadičku, ktorej koniec zasunieme
do suchej skúmavky obrátenej hore dnom. K hydroxidu sodnému
po kvapkách pridávame koncentrovaný roztok hydroxidu amónneho
z 5 cm3 injekčnej striekačky. Vznikajúci plynný
amoniak zachytávame do skúmavky. Po úplnom naplnení skúmavky
amoniakom (overíme si to pomocou indikátorového papierika
priloženého k ústiu skúmavky), skúmavku rýchlo uzavrieme
gumenou zátkou prepichnutou injekčnou ihlou (skúmavku stále
držíme hore dnom). Na ihlu nasadíme 20 cm3 injekčnú
striekačku naplnenú vodou, do ktorej pridáme pár kvapiek
fenolftaleínu. Do skúmavky vstrekneme trochu vody z injekčnej
striekačky, čím dôjde k iniciácii reakcie (obr.30). Skúmavku
jednoduchého vyvíjača plynu naplníme asi 5 granulami
hydroxidu sodného. Na jednu
injekčnú ihlu nasadíme 5 cm3 injekčnú striekačku,
na druhú nasadíme gumenú hadičku, ktorej koniec zasunieme
do suchej skúmavky obrátenej hore dnom. K hydroxidu sodnému
po kvapkách pridávame koncentrovaný roztok hydroxidu amónneho
z 5 cm3 injekčnej striekačky. Vznikajúci plynný
amoniak zachytávame do skúmavky. Po úplnom naplnení skúmavky
amoniakom (overíme si to pomocou indikátorového papierika
priloženého k ústiu skúmavky), skúmavku rýchlo uzavrieme
gumenou zátkou prepichnutou injekčnou ihlou (skúmavku stále
držíme hore dnom). Na ihlu nasadíme 20 cm3 injekčnú
striekačku naplnenú vodou, do ktorej pridáme pár kvapiek
fenolftaleínu. Do skúmavky vstrekneme trochu vody z injekčnej
striekačky, čím dôjde k iniciácii reakcie (obr.30).
Pozorovanie
Zvyšok
vody v injekčnej striekačke sa sám nasáva a
vystrekuje do skúmavky ako fontánka. Dôkazom zásaditej
reakcie je fialové sfarbenie acidobázického indikátora
fenolftaleínu).
|