Chlór
1. Príprava
chlóru
Princíp práce
Chlór
pripravíme reakciou manganistanu draselného KMnO4
a kyseliny chlorovodíkovej HCl:
2 KMnO4 + 16 HCl
®
5 Cl2 +
2 KCl + 2 MnCl2 + 8 H2O
Pomôcky a chemikálie
jednoduchý
vyvíjač plynu, adsorpčná trubička, manganistan draselný
KMnO4, kyselina chlorovodíková HCl (koncentrovaná)
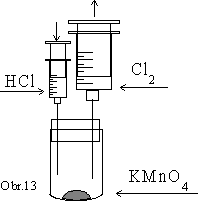 Postup
práce Postup
práce
Do
suchej skúmavky vyvíjača plynu dáme 1 malú lyžičku
manganistanu draselného
a uzavrieme ju gumenou zátkou.
Z 5 cm3 injekčnej
striekačky opatrným, pomalým stláčaním piesta pridávame
kyselinu chlorovodíkovú (max. 5 cm3) k manganistanu
draselnému v skúmavke. Vznikajúci chlór vytláča
piest v 50 cm3 injekčnej striekačke
(obr.13). Naplnenú injekčnú
striekačku odoberieme a injekčnú ihlu uzavrieme
adsorpčnou trubičkou s aktívnym uhlím.
Poznámky
·
Pomalým pridávaním kyseliny
chlorovodíkovej zabránime silnému zahriatiu reakčnej
zmesi, čo by spôsobilo tvorbu kyslíka O2.
·
Aby nám v 50 cm3 injekčnej
striekačke nevznikol pretlak, v okamihu, keď je dvíhajúci
sa piest striekačky už takmer hore, jemne ho potiahneme
nahor.
·
Ak potrebujeme čistý chlór,
použijeme až druhý obsah striekačky. Prvý obsah striekačky
obsahuje zmes vzduch-chlór (hore vzduch, dole chlór).
·
prítomnosti chlóru v striekačke
sa presvedčíme vytlačením malého množstva obsahu striekačky
na jódškrobový papierik
(v prítomnosti chlóru papierik zmodrie).
·
Jednorázové injekčné ihly
treba po každom
pokuse vymeniť (chlór je veľmi agresívny a spôsobuje koróziu
ihiel).
Bezpečnosť
·
Odporúčame zvýšenú opatrnosť
pri práci s plynným chlórom
Cl2! Plynný chlór nikdy nesmieme priamo vdychovať
(nebezpečenstvo poškodenia pľúc – vznik edému pľúc) !
·
Pri správnom zaobchádzaní s pomôckami a dodržiavaní pokynov je
práca s chlórom bezpečná. Napriek tomu však vyvíjajúci
sa chlór „zneškodníme“ alkalickým roztokom sódy, ktorý
rozprašovačom rozprášime na hmlu.
Zneškodnenie splodín
Nezreagovaný
chlór vytlačíme zo striekačky do roztoku hydroxidu sodného
(w=10%) alebo priamo do odtoku umývadla pri otvorenom
vodovodnom kohútiku.
2.
Vlastnosti chlóru
Chlór
je žltozelená jedovatá plynná látka. Reaguje s väčšinou prvkov už pri izbovej teplote -
je to jeden z najreaktívnejších nekovov. Má
bieliace a dezinfekčné
účinky. S vodíkom tvorí chlórovú traskavú zmes.
a)
zlučovanie sodíka s chlórom
Princíp práce
Reakciou
sodíka s chlórom vzniká biela pevná látka –
chlorid sodný NaCl. Priebeh chemickej reakcie znázorňuje
chemická rovnica:
2 Na + Cl2
®
2 NaCl
Pomôcky a chemikálie
50
cm3 injekčná striekačka s injekčnou ihlou
naplnená plynným chlórom Cl2,, sodík, pinzeta,
nôž, filtračný papier, suchá skúmavka, kahan, držiak na
skúmavky, porcelánová miska so suchým pieskom, destilovaná
voda, roztok dusičnanu strieborného AgNO3, vodný
roztok kuchynskej soli NaCl
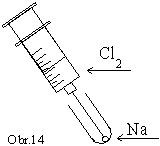 Postup
práce Postup
práce
Kúsok
očisteného sodíka (veľkosti hrášku) vložíme do suchej
skúmavky. Skúmavku opatrne zahrievame nad kahanom až do
roztavenia sodíka (kým sodík nezačne „iskriť“). Vtedy
prestaneme skúmavku zahrievať
a pomocou striekačky s injekčnou ihlou vytláčame
vopred pripravený chlór priamo na
roztavený sodík (obr. 14).
Pozorovanie
Sodík
v skúmavke prudko vzplanie a na stenách skúmavky sa
vytvorí biela pevná látka
- chlorid sodný NaCl (kuchynská soľ). Reakcia je
silne exotermická – súvisí to s uvoľňovaním
energie pri tvorbe kryštálovej mriežky vznikajúceho
chloridu sodného.
b)
bieliaci účinok chlóru
Princíp práce
Bieliaci
účinok vlhkého chlóru Cl2 spočíva v tvorbe
kyseliny chlórnej HClO, ktorá sa ľahko rozkladá na aktívny
kyslík O2, ktorý bieli rôzne farbivá. Svetlom
sa táto reakcia urýchľuje.
Cl2 + H2O
®
HClO
2 HClO
®
2 HCl + O2
Pomôcky a chemikálie
jednoduchý
vyvíjač plynu, lupienky červených kvetov (druh kvetov podľa
ročného obdobia), pásiky filtračného papiera, atramentové
pero, farebné fixky
 Postup
práce Postup
práce
Do
50 cm3 injekčnej striekačky vložíme lupienky červených
kvetov, resp. pásiky filtračného papiera, na ktoré sme
urobili farebné pruhy atramentom alebo farebnými fixkami. Ak
použijeme lupienky kvetov, rozotrieme ich pred použitím
medzi prstami, aby sme odstránili hydrofóbnu vrstvu na
povrchu. Injekčnú striekačku nasadíme na jednoduchý vyvíjač
plynu (obr.15) a naplníme chlórom.
Pozorovanie
Lupienky
kvetov, resp. pásiky
filtračného papiera sa vplyvom plynného chlóru odfarbia.
c)
dezinfekčný účinok chlóru
Princíp práce
Chlór
sa vyznačuje veľmi dobrými dezinfekčnými účinkami (ničí
mikroorganizmy, odstraňuje zápach pri hnilobných
procesoch). Dezinfekčné účinky chlóru spôsobuje atómový
kyslík, ktorý vzniká rozkladom kyseliny chlórnej v chlórovej
vode:
HClO ®
HClO + O
Pomôcky a chemikálie
skúmavka,
gumená zátka prepichnutá injekčnou ihlou, 50 cm3
striekačka naplnená plynným chlórom, znečistená voda
(zapáchajúca voda po kvetoch vo váze)
Postup práce
Skúmavku
naplníme znečistenou vodou a uzavrieme gumenou zátkou s injekčnou
ihlou. Na injekčnú ihlu nasadíme injekčnú striekačku, z
ktorej vytlačíme pripravený chlór do vody v skúmavke.
Pozorovanie
Po
chvíľke porovnáme zápach pôvodnej vody a vody, do ktorej
sme zaviedli plynný chlór.
d)
reakcia chlóru so železom
Princíp práce
Chlór
je silné oxidačné činidlo. Môže oxidovať mnohé kovy.
So zahriatym železom reaguje chlór priamo:
2 Fe + 3 Cl2
®
2 FeCl3
Pomôcky a chemikálie
50
cm3 injekčná striekačka s injekčnou ihlou
naplnená plynným chlórom, železná vlna Fe, skúmavka, držiak
na skúmavky, kahan
 Postup
práce Postup
práce
Kúsok
železnej vlny v hornej časti skúmavky silne zahrejeme
kahanom. Na horúce železo vytláčame z injekčnej striekačky
cez injekčnú ihlu pripravený plynný chlór (obr.16).
Pozorovanie
Železo
sa za úbytku energie zlučuje s plynným chlórom na
hnedý chlorid železitý.
e)
reakcia chlóru so sulfánom
Princíp
Všetky
halogény majú oxidačné vlastnosti. Oxidujú napríklad síru
v sulfáne na elementárnu síru:
H2S
+ Cl2 ®
2 HCl + S
Reakcie prebiehajú vo vodných roztokoch (jedna z reagujúcich
látok musí byť rozpustená vo vode) a používajú sa na prípravu
čistej kyseliny bromovodíkovej a kyseliny jodovodíkovej.
Pomôcky
a chemikálie
skúmavka,
indikátorový papierik, sulfánová voda, 50 cm3 injekčná
striekačka naplnená plynným chlórom Cl2
Postup
práce
Do
skúmavky so sulfánovou vodou vytlačíme z 50 cm3 injekčnej
striekačky pripravený plynný chlór.
Pozorovanie
Pôsobením
chlóru sa sulfánová voda zakalí. Vylučuje sa biely zákal
síry. Roztok má v dôsledku vzniku kyseliny chlorovodíkovej
slabo kyslú reakciu, ktorú dokážeme použitím indikátorového
papierika.
f)
reakcia chlórového traskavého plynu
Princíp práce
Zmes
chlóru a vodíka (chlórová traskavá zmes) exploduje po
zahriatí alebo účinkom svetla (napr. slnečné svetlo,
blesk fotoaparátu). Molekuly chlóru sa štiepia účinkom
svetelnej energie na radikály, ktoré naštartujú reťazovú
radikálovú reakciu. Vzniká chlorovodík, štipľavo zapáchajúci
jedovatý plyn.
Pomôcky a chemikálie
dva
jednoduché vyvíjače plynu, adsorpčná trubička, fotoaparát
s bleskom, ochranný drôtený kôš, hliníková fólia,
šatka, granulovaný zinok Zn,
kyselina chlorovodíková HCl (koncentrovaná),
manganistan draselný KMnO4,
kyselina chlorovodíková HCl (koncentrovaná)
Postup práce
50
cm3 striekačku
naplníme pomocou jednoduchého vyvíjača plynu 25 cm3
čistého vodíka. Striekačku previažeme šatkou a z druhého
vyvíjača plynu k vodíku pridáme presne 25 cm3
plynného chlóru. Injekčnú striekačku potom zapichneme
injekčnou ihlou kolmo do polystyrénovej dosky, postavíme do
drôteného ochranného koša a odstránime z nej šatku.
Blesk fotoaparátu priložíme priamo k injekčnej
striekačke a stlačíme spúšť fotoaparátu. Odporúčame
mimoriadnu opatrnosť.
Pozorovanie
Pôsobením
svetla zmes chlóru a vodíka exploduje.
g)
oxidačné účinky voľných halogénov
Princíp práce
Halogény
prejavujú výrazné oxidačné účinky, ktoré postupne
klesajú v rade fluór, chlór, bróm a jód. Znamená
to, že brómom môžeme vytesniť len jód, nie chlór. Pri
pokuse vytesníme chlórom bróm a následne jód vzniknutým
brómom.
Cl2
+ 2 KBr ®
2 KCl + Br2
Br2
+ 2 KI ®
2 KBr + I2
Pomôcky
a chemikálie
reagenčná
rúrka, ohnutá odvodná rúrka, skúmavka, železný stojan,
stojan na skúmavky, gumená zátka prepichnutá injekčnou
ihlou, gumená hadička, vatové tampóniky, 50 cm3
injekčná striekačka naplnená plynným chlórom,
nasýtené roztoky bromidu draselného KBr a jodidu draselného
KI, chlorid uhličitý CCl4
Postup
práce
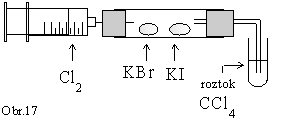 Do
stojana upevníme reagenčnú rúrku. Do nej vsunieme dva
vatové tampóniky, prvý namočený
do nasýteného roztoku bromidu draselného (zľava),
druhý do roztoku jodidu draselného (sprava). Reagenčnú rúrku
na oboch koncoch uzavrieme -
zľava gumenou zátkou prepichnutou injekčnou ihlou a
sprava gumenou hadičkou s ohnutou odvodnou rúrkou.
Koniec odvodnej rúrky ponoríme do skúmavky s organickým
rozpúšťadlom (chloridom uhličitým). Cez injekčnú ihlu
zavedieme do reagenčnej rúrky pripravený chlór (obr.17). Do
stojana upevníme reagenčnú rúrku. Do nej vsunieme dva
vatové tampóniky, prvý namočený
do nasýteného roztoku bromidu draselného (zľava),
druhý do roztoku jodidu draselného (sprava). Reagenčnú rúrku
na oboch koncoch uzavrieme -
zľava gumenou zátkou prepichnutou injekčnou ihlou a
sprava gumenou hadičkou s ohnutou odvodnou rúrkou.
Koniec odvodnej rúrky ponoríme do skúmavky s organickým
rozpúšťadlom (chloridom uhličitým). Cez injekčnú ihlu
zavedieme do reagenčnej rúrky pripravený chlór (obr.17).
Pozorovanie
Chlór
vytesní z bromidu draselného bróm. Uvoľnené pary brómu prechádzajú rúrkou a oxidujú
jodid draselný v druhom tampóniku na jód. Jódové
pary sa zachytávajú a rozpúšťajú sa v organickom
rozpúšťadle.
h)
zlučovanie chlóru s jódom
Princíp
práce
Halogény
sa môžu vzájomne zlučovať na binárne zlúčeniny typu XY
rôzneho zloženia, kde X je halogén s vyšším a Y s nižším
protónovým číslom. Zlúčeniny typu XY a XY sa dajú
pripraviť priamym zlučovaním príslušných halogénov.
Napríklad
jód sa zlučuje s chlórom na chlorid jodný ICl:
Cl2 + I2
®
2 ICl
Pôsobením
nadbytku chlóru na jód vznikajú žlté, na vzduchu rozplývavé
kryštáliky chloridu joditého ICl – chlorid jodný sa
postupne mení na chlorid joditý:
ICl
+ Cl2 ®
ICl3
Pomôcky a
chemikálie
rovná
sklenená rúrka, ohnutá odvodná rúrka, gumená hadička,
skúmavka, železný stojan, špachtľa, 50 cm3
injekčná striekačka naplnená plynným chlórom,
práškový jód, roztok hydroxidu draselného KOH (4mol/dm3)
Postup práce
 Sklenenú
rúrku upevníme vodorovne do stojana a špachtľou do nej
vpravíme práškový jód, ktorý rovnomerne rozptýlime po
celej dĺžke. Rúrku uzavrieme sprava gumenou hadičkou s ohnutou
odvodnou rúrkou, ktorú vložíme do skúmavky s roztokom
hydroxidu draselného. Zľava ju uzavrieme gumenou zátkou
prepichnutou injekčnou ihlou, cez ktorú rovnomerne vytláčame
pripravený chlór (obr.18). Sklenenú
rúrku upevníme vodorovne do stojana a špachtľou do nej
vpravíme práškový jód, ktorý rovnomerne rozptýlime po
celej dĺžke. Rúrku uzavrieme sprava gumenou hadičkou s ohnutou
odvodnou rúrkou, ktorú vložíme do skúmavky s roztokom
hydroxidu draselného. Zľava ju uzavrieme gumenou zátkou
prepichnutou injekčnou ihlou, cez ktorú rovnomerne vytláčame
pripravený chlór (obr.18).
Pozorovanie
Stykom
chlóru s jódom vzniká rubínovočervený chlorid jodný.
Ďalším pôsobením chlóru sa červené kryštáliky menia
na žlté. Vzniká chlorid joditý.
i) poznámky
k pokusom
ad
a) zlučovanie sodíka s chlórom
·
Pripravený produkt môžeme
porovnať s kuchynskou soľou. Pripravíme si vodné
roztoky týchto látok – chloridu sodného (získaného zo
stien skúmavky) a kuchynskej soli. Vo vzniknutých roztokoch
dokážeme prítomnosť chloridových aniónov Cl-
reakciou s roztokom duičnanu strieborného AgNO3,
pri ktorej vzniká
biela zrazenina chloridu strieborného AgCl:
NaCl + AgNO3
®
AgCl + NaNO3.
Dôkazové
reakcie vzniknutého produktu a kuchynskej soli porovnáme.
·
Pri práci so sodíkom musíme
byť opatrní – je vhodné používať ochranný štít!
·
Vzhľadom na silne exotermický
charakter reakcie odporúčame použiť skúmavku z ťažkotaviteľného
skla a pokus uskutočňovať nad porcelánovou miskou so suchým
pieskom.
·
Analýzu
produktu nikdy nerobíme pridaním vody priamo do reakčnej skúmavky!
Môže
nastať prudká reakcia zvyškov nezreagovaného sodíka s vodou.
·
Zvyšky sodíka v skúmavke
zlikvidujeme etanolom.
·
Nadbytočný chlór vytláčame
zo striekačky s injekčnou ihlou priamo do odtoku umývadla
alebo do roztoku hydroxidu sodného (w=10%).
ad
b) bieliaci účinok chlóru
·
Lupienky po vložení do striekačky
navlhčíme kvapkou vody.
·
Pásiky filtračného papiera
nafarbíme fixkami, ktoré sú vo vode rozpustné.
ad
c) dezinfekčný účinok chlóru
·
Rozklad kyseliny chlórnej sa urýchľuje
na svetle. Na priamom slnečnom svetle môžeme dokonca
pozorovať vývoj kyslíka z chlórovej vody.
ad
d) reakcia chlóru so železom
·
Analogicky môžeme urobiť
pokus s medeným drôtikom. Reakciou medi s chlórom
vznikne zelený chlorid meďnatý
CuCl2 :
Cu + Cl2
®
CuCl2
ad
e) reakcia chlóru so sulfánom
·
Reakciu chlóru so sulfánom môžeme
uskutočniť aj v plynnom skupenstve. Zmiešame obidva
plyny v skúmavke, skúmavku uzatvoríme a obsah premiešane
pretrepaním. Pozorujeme vznik bieleho dymu (zmes chlorovodíka
a síry).
·
Podobne reaguje so sulfánom aj
bróm. Do brómovej vody zavedieme pripravený plynný sulfán,
ktorý spôsobí postupné odfarbenie brómovej vody a vylučovanie
síry (biely zákal).
ad
f) reakcia chlórového traskavého plynu
·
Množstvo dopadajúceho svetla môžeme
zvýšiť odrazom hliníkovej fólie umiestnenej za injekčnou
striekačkou.
·
V okolí drôteného koša
by nemali byť žiadne ľahko rozbitné predmety, pretože piest injekčnej striekačky môže byť dosť veľkou silou
„vymrštený“ nahor. Pozor na lampy a žiarovky !
·
Po reakcii môžeme dokázať
vznik chlorovodíka v striekačke navlhčeným indikátorovým
papierikom.
|