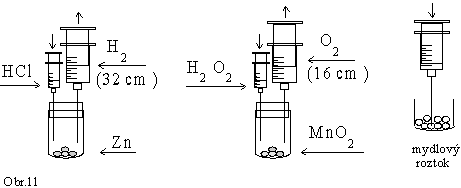
Kyslík
|
 |
Pozorovanie
Reakcia je prudká, zmes plynov reaguje so silným zvukovým efektom.
Princíp práce
Železo
vo vlhkom prostredí účinkom kyslíka hrdzavie. Reakciu
hrdzavenia železa vyjadruje chemická rovnica:
2
Fe + O2
+ 3 H2O ®
2 Fe(OH)3
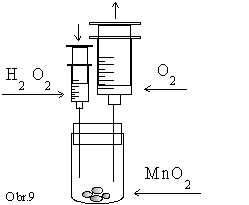
Pomôcky a chemikálie
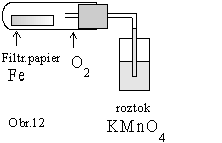
skúmavka, prúžok filtračného papiera, gumená zátka, ohnutá kapilárna rúrka, kadička, práškové železo Fe, manganistan draselný KMnO4, 50 cm3 injekčná striekačka s injekčnou ihlou naplnená kyslíkom
 Postup
práce
Postup
práce
Z injekčnej striekačky vytlačíme do skúmavky pripravený kyslík a vložíme do nej navlhčený prúžok filtračného papiera, posypaný práškovým železom. Skúmavku tesne uzavrieme gumenou zátkou, cez ktorú prechádza tenká kapilárne zúžená rúrka. Koniec rúrky ponoríme do kadičky so zafarbenou vodou. Pozorujeme vodný stĺpec v rúrke (obr.12).
Pozorovanie
Manganistanom
draselným sfarbená voda stúpa v kapiláre smerom ku skúmavke.
Železo, jemne rozpráškované, reaguje s kyslíkom za
prítomnosti vody a vzniká hydroxid železitý (hrdza).
e)
horenie chemických prvkov v čistom kyslíku
Princíp práce
Horením
chemických prvkov s kyslíkom vznikajú príslušné
oxidy.
S
+ O2 ®
SO2
4
Fe + O2
®
2 Fe2O3
Pomôcky a chemikálie
hrubostenné skúmavky, spaľovacia lyžička, kahan, zápalky, injekčné striekačky naplnené čistým kyslíkom, síra, železo, drevné uhlie, acidobázický indikátor, číra vápenná voda ( nasýtený roztok hydroxidu vápenatého Ca(OH)2)
Postup práce
· Kúsok kryštalickej síry zohrejeme na spaľovacej lyžičke nad kahanom a po zapálení ju vložíme do skúmavky naplnenej kyslíkom.
· Na spaľovaciu lyžičku dáme kúsok železa s kúskom zápalky. Po zapálení zápalky rýchlo vsunieme spaľovaciu lyžičku do skúmavky s kyslíkom.
· Kúsok drevného uhlia rozžeravíme na spaľovacej lyžičke nad kahanom a vložíme ho do skúmavky s kyslíkom.
Pozorovanie
· Síra horí jasným modrofialovým plameňom. Produktom horenia je ostro zapáchajúci oxid siričitý.
· Najprv zhorí dobre horiaca látka – zápalka a od nej sa zapáli železo, pričom sa tvoria iskry, ktoré sa rozletujú všetkými smermi. Horením vznikne tmavý prášok oxidu železitého.
· Pri horení vzniká oxid uhličitý. Vzniknutý produkt môžeme rozpustiť vo vode a dokázať indikátorovým papierikom (slabá kyselina uhličitá) alebo v čírej vápennej vode (slabý zákal uhličitanu vápenatého).
f)
poznámky
k pokusom
ad
a) dôkaz kyslíka
·
Na dôkaz kyslíka použijeme až
druhý alebo tretí obsah injekčnej striekačky.
ad
d) spotreba kyslíka pri hrdzavení železa
·
Hrdzavenie môžeme urýchliť
miernym zahriatím skúmavky.
ad
e) horenie chemických prvkov v čistom kyslíku
· Zbytky prvkov zahasíme ponorením spaľovacej lyžičky do vody.
· Vápennú vodu si pripravíme rozpustením a rozmiešaním hydroxidu vápenatého v destilovanej vode. Nerozpustenú časť hydroxidu vápenatého odstránime filtráciou.
[návrat]
Posledná aktualizácia: 08.08.2001